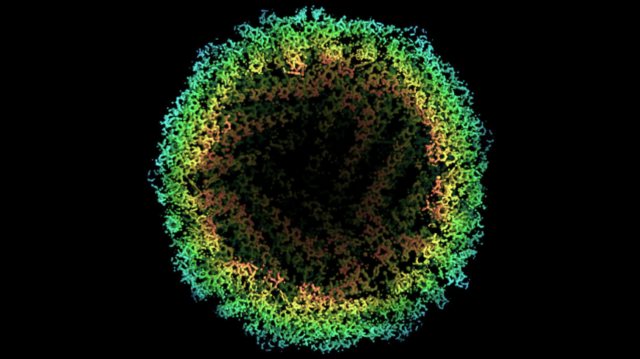
În prezent, există doar câteva opțiuni în ceea ce privește maparea celor mai mici proteine: se poate încerca alinierea a milioane de molecule de proteine în cristale și analizarea acestora utilizând cristalografia cu raze X, sau se pot congela copii ale proteinei și bombarda cu electroni, folosind o metodă de rezoluție mai mică numită microscopie crio-electronică (crio-EM). Totuși, pentru prima dată, oamenii de știință au reușit să crească rezoluția crio-EM până la nivelul atomic, permițându-le astfel să identifice pozițiile atomilor în proteine, la o rezoluție care rivalizează cu cristalografia cu raze X.
„Este uimitor”, a declarat Melanie Ohi, expertă în crio-EM, în cadrul Universității din Michigan. „Este extraordinar faptul că putem observa un detalia la un astfel de nivel”. Datorită rezoluției ridicate, acum se pot observa mecanismele de funcționare ale complexelor celulare. Astfel, îmbunătățirile crio-EM ar trebui să ofere nenumărate noi perspective asupra biologiei.
Pentru cartografierea structurilor proteinelor, oamenii de știință utilizează cristalografia cu raze X, încă de la sfârșitul anilor 1950. Bombardând proteinele cristalizate cu raze X și analizând modul în care acestea se reflectă, oamenii de știință pot determina forma aproximativă a unei proteine. Decenii de îmbunătățiri ale fasciculelor de raze X, detectoarelor și puterii de calcul au făcut ca această abordare să fie rapidă și precisă. Cu toate acestea, abordarea nu funcționează optim atunci când proteinele sunt foarte mari, ci funcționează sub formă de complexe precum ribozomul sau nu pot fi cristalizate, cum este cazul multor proteine localizate în membranele celulare.
În schimb, cercetătorii care utilizează fasciculul de electroni în cazul crio-EM, asupra unor copii ale proteinelor înghețate, care nu trebuie cristalizate, detectoarele înregistrează deviațiile electronilor, iar software-ul îmbină imaginile pentru a elabora forma acestora. Anterior, cercetătorii din Japonia au demonstrat că ar putea reduce rezoluția la 1,54 angstromi, aceasta valoare nefiind însă suficientă pentru a ajunge în punctul în care s-ar putea distinge atomii, într-o proteină intestinală numită apoferitină, care creează legături cu fierul. Acum, cu ajutorul îmbunătățirilor tehnologiei fasciculului de electroni, a detectoarelor și a software-ului, două grupuri de cercetători din Marea Britanie și Germania au redus această rezoluție la o valoare de 1,25 angstrom, suficient de mult pentru a stabili poziția atomilor individuali.
Rezoluția îmbunătățită ar putea accelera trecerea la crio-EM în rândul biologilor structurali. Deocamdată, tehnica funcționează doar în cazul proteinelor care sunt foarte rigide. În continuare, cercetătorii se vor strădui să obțină o rezoluție bună și în cazul complexelor proteice mari, mai puțin rigide, cum ar fi spliceozomul, un complex mare de proteine și molecule de ARN, care distruge „intronii” din ARN-ul care urmează să fie transformat în proteine.